一、我的理解:基因表达的调控可在多个层次上进行,包括基因水平、转录水平、转录后水平、翻译水平和翻译后水平的调控。
二、网络文章摘录:从遗传学中心法则看,基因表达沉默无非从两个水平研究,先将具体方法总结如下
1基因组DNA水平
1.1 构建基因重组打靶载体
基因功能研究中出现最早最成熟的技术就是基因敲除. 他是根据同源重组的原理, 利用分子生物学技术增强和减弱甚至灭活某特定靶基因表达水平, 然后观察实验动物整体功能状态的变化, 推测靶基因的功能[1]. 基因敲除技术可在整体动物水平研究基因功能, 但是完全基因敲除使小鼠所有细胞基因组上都存在基因的缺失或突变, 有些重要的靶基因敲除或导入会严重影响动物胚胎的发育, 导致胚胎早期死亡或严重的发育缺陷, 使得突变无法传代, 不利于在小鼠各个发育阶段进行该基因功能的分析. 条件基因敲除技术(conditional gene knock out)的建立为此难题找到了解决的办法. 1994年, Gu et al [2]应用Cre/loxP重组酶系统实现了外源基因的时间特异性表达, 在此基础上条件基因敲除技术得以形成. 条件基因敲除技术是在基因敲除基础上结合Cre/loxP系统而形成的, 他可以做到在特定时间, 组织, 细胞中将靶基因敲除, 从而可以真实的反映特定组织或细胞中靶基因被敲除或修饰后的结果, 避免在发育早期所有细胞和组织中完全敲除目的基因后可能产生的胚胎早期死亡或严重的发育障碍[3-5]. 基因敲除的优点是基因灭活效果确切可靠, 缺点是技术复杂, 费时费力.
1.2 反义寡核苷酸技术
反义寡核苷酸技术是指采用一类经人工合成或构建的反义表达载体表达的寡核苷酸片段, 长度多为15-30个核苷酸, 导入细胞或者个体体内, 根据碱基互补原理, 通过与靶DNA或者mRNA结合形成双链杂交体激活核酸酶H, 裂解靶mRNA阻断蛋白质的翻译, 或者与DNA结合成三链结构或与单链DNA结合成双链结构以阻止靶基因的复制或转录, 以及与mRNA AP位点结合干扰其剪接、加工和运输, 在mRNA水平上发挥作用, 从而干扰其表达, 阻止其翻译成蛋白质[6]. 具体的作用机制目前尚未完全清楚. 反义寡核苷酸因为是针对特定的靶mRNA(DNA)的序列设计合成, 因此具有极高的特异性, 并且容易设计和体外大量合成. 另外反义寡核苷酸不含病毒序列, 不会产生免疫反应, 也不会整合入宿主染色体内, 这都为其作为药物应用于临床提供了可能. 1998年, 第1个反义药物Vitravene(Fomivirsen)被美国FDA批准通过, 用以治疗由巨细胞病毒(cytomegalovirus)引起的艾滋患者的视网膜炎[7]. 目前反义寡核苷酸技术在动物体内外的应用已经非常普遍[8-9]. 今后要注意的是, 如何对反义寡核苷酸进行更加有效的化学修饰以提高其稳定性, 延长其半衰期, 增加其作用时间和如何定点作用于特定部位, 使靶组织最大效率地吸收反义核酸, 提高其作用效果, 减轻毒副作用[10].
1.3 甲基化寡核苷酸技术
表观遗传学(epigenetics)是与遗传学(genetics)相对应的概念. 遗传学是指基于基因序列改变所致基因表达水平变化, 包括基因突变、基因杂合丢失和微卫星不稳定性等;而表观遗传学则是指基于非基因序列改变所致基因表达水平变化, 包括DNA甲基化、组蛋白脱乙酰化和染色质构象变化等; 表观基因组学(epigenomics)则是在基因组水平上对表观遗传学改变的研究, 以抑癌基因为代表的CpG岛甲基化所致基因转录失活已经成为肿瘤表观基因组学研究的重点内容[23-25]. 所谓DNA甲基化是指在DNA甲基化转移酶的作用下, 基因组5'端CpG二核苷酸的胞嘧啶第5位碳原子上共价结合一个甲基基团. 由于DNA甲基化与人类发育和肿瘤疾病的密切关系, 特别是CpG岛甲基化所致抑癌基因转录失活, DNA甲基化已经成为表观遗传学和表观基因组学的重要研究内容, 研究DNA甲基化与肿瘤的关系成为当前分子生物学的热点之一. 目前的研究已经表明: 肿瘤细胞和组织中存在异常的DNA甲基化状态, 表现为基因组整体甲基化水平降低, 导致遗传不稳定性增加;组织特异性基因的启动子区域出现从头甲基化从而导致基因被关闭; 原癌基因多为低甲基化或不充分甲基化, 低甲基化使原癌基因活化, 导致重新开放或异常表达, 形成突变热点, 增加染色体的不稳定性; 抑癌基因多为过度甲基化, 过度甲基化导致表达失活[26-27]. 这些因素综合起来导致基因表达异常, 引起细胞恶变, 最终导致肿瘤的发生[28-30].在哺乳动物中, 甲基化仅影响DNA链上鸟嘌呤前的胞嘧啶(CpG). 通常细胞中CpG二核苷酸的甲基化分布并不是均一的, 大约50%的基因在启动子区域有CpG二核苷酸的富集现象, 一般该区域的长度从0.5-2 kb不等. 该区域与基因的转录有密切的关系, 通常处于非甲基化状态. 处于非甲基化状态的启动子, 环绕的染色质呈现为开放的构象, 允许转录因子和其他的激活物靠近. 此外, 转录因子的占据也使其他的转录抑制因子和染色质重塑蛋白等难以接近启动子, 最终表现为启动基因表达[31-33]. 相反, CpG岛高甲基化的启动子则呈现为关闭的构象, 不但使转录因子无法靠近, 而且还有助于甲基胞嘧啶结合蛋白、转录辅阻遏蛋白、DNA甲基转移酶等对转录有抑制作用的蛋白结合于启动子区, 启动子失去功能, 结果基因转录灭活而沉默[34-35]. 很多资料表明, 基因启动子异常高甲基化可以导致其转录灭活[36-39]. Zhu et al [40]通过甲基化寡核苷酸诱导ERβ基因启动子区和外显子区CpG岛特异性甲基化发现, 在前列腺癌细胞中, 是ERβ基因启动子区(而不是外显子区)CpG岛的高甲基化导致了ERβ基因转录失活. 去甲基化试剂作用前列腺癌细胞后, ERβ mRNA恢复表达.
甲基化寡核苷酸技术是利用针对靶基因合成的甲基化寡核苷酸片段(methylated oligonucleotides,MON)与基因的其中一条链互补结合形成半甲基化DNA. 半甲基化DNA表现为复制叉样结构, 为DNA甲基化转移酶1(DNA methyltransferase-1, DNMT1)的优先底物, DNMT1使第1链迅速甲基化. MON与结合点分离, 甲基化的第一链与未甲基化的互补链退火形成第2个半甲基化DNA底物, 同样表现为复制叉样结构, 为DNMT1作用的优先底物. 结果两条链均发生甲基化, 随后, 同样的道理, 甲基化扩布到邻近的CpG二核苷酸中, 最后整个基因的靶位点(如启动子)发生完全甲基化[41]. 如上所述, 基因启动子甲基化可以导致其转录失活, 因此通过甲基化寡核苷酸技术, 我们就可以对所要研究的目的基因进行特异的灭活[42-43]. 此外, 尚有资料表明,CpG岛甲基化表型(CIMP)能够改变染色体的构象, 产生微卫星不稳定性(MSI)现象, 引起靶基因突变失活[44-49]. 这种有趣的现象使遗传学和表观遗传学之间建立起了桥梁, 为研究两者之间的联系提供了思路[50]. 基因CpG岛的这种甲基化修饰具有可遗传性, 能够对发育、生理、环境、病理等不同的信号作出反映, 使遗传信息的表达按一定程序发生变化, 参与完成细胞的时空调控和适应调控, 在胚胎发育障碍等先天性疾病以及恶性肿瘤发病机制中起至关重要的作用.
甲基化寡核苷酸技术的实施路线包括: (1)MON的设计与合成: MON是包含20余个碱基的一小段寡核苷酸片段, 与目的基因启动子区对应位置的碱基序列完全相同, 不同的是MON片段中的5'端CpG二核苷酸中的胞嘧啶环5位碳原子发生甲基化(m5CpG). 而GenBank数据库中原始的目的基因启动子区的CpG二核苷酸并未发生甲基化修饰(CpG). MON片段设计时应注意至少包含3个CpG二核苷酸, 理论上MON片段中所含的m5CpG越多越好, 这样才能达到更好的甲基化诱导效果. 为了防止在细胞中被酶降解, 寡核苷酸片段还需进行硫代磷酸化等修饰, 此外还可以标记荧光来示踪, 同时还需要设计非甲基化寡核苷酸片段(unmethylatedoligonucleotides, UMON)作为对照. UMON碱基序列与MON完全相同, 不过没有进行CpG二核苷酸甲基化修饰. MON的合成与引物合成一样, 可由DNA自动合成仪来完成, 价格比较低廉. MON的作用: 针对体外细胞的应用, 通常采用的是脂质体介导的基因转染, 体内实验的资料目前不多. 目前把MON导入体内外的基因转染方法主要有两大类: 一类为病毒介导法, 即利用去掉了致病基因的病毒序列作为载体, 将外源靶基因导入靶细胞内, 常用的有逆转录病毒、疱疹和腺病毒等改建的病毒载体; 另一类为非病毒介导法, 包括物理法(显微注射、气溶胶、基因枪和缝线等)、化学法(磷酸钙沉淀法、脂质体法和葡聚糖法等)和生物学法(细胞融合法和受体法等). (3)效果评价: 提取基因组DNA和总RNA以及蛋白质, 采用甲基化特异性PCR(MSP)、亚硫酸氢盐测序(BSP)、RT-PCR、Western blot等手段进行相关的分析. 其中, MSP法可以了解是否发生了特异性的甲基化诱导,BSP可以对那些发生了甲基化的CpG进行精确定位[51-53]. RT-PCR、Western blot则可以从不同分子水平判断基因灭活的效果及其他相关分析.
目前甲基化寡核苷酸技术的应用多集中在肿瘤细胞系[60-61], 这实际上就是把他作为一种基因沉默的工具应用到过度表达的肿瘤相关基因的研究中, 借此观察这些靶基因的功能. 甲基化寡核苷酸技术在此所起的作用可以用前述的其他基因沉默工具代替. 然而, 甲基化寡核苷酸技术尚具有基因敲除等技术所不能代替的优点. 例如, 针对肿瘤细胞中抑癌基因启动子发生甲基化而失活, 我们就可以将正常的组织细胞或动物模型作为研究对象, 采用甲基化寡核苷酸技术来诱导其发生甲基化而失活, 模拟肿瘤细胞和组织中该基因的甲基化行为, 从而生动地再现肿瘤细胞和组织中抑癌基因甲基化灭活的过程, 达到相关研究的目的. 这主要是基于甲基化寡核苷酸技术的作用机制和肿瘤细胞中的抑癌基因的基因型. 实际上肿瘤相关基因启动子高甲基化导致转录沉默, 甚至发生MSI突变方面的文献数不胜数[44-49]. 因此, 甲基化寡核苷酸技术的应用大有前景, 而这正是其他基因沉默工具所不能比拟的. 目前甲基化寡核苷酸技术应用于体内实验的资料不多, 毒副作用的研究很少, 和反义寡核苷酸技术以及干扰RNA技术等其他基因治疗手段存在的问题一样. 如何高效、靶向、安全地把这种神奇的甲基化寡核苷酸片段应用到个体体内是目前存在的问题之一,这有赖于靶向载体研究的进展.
1.4 锌指核酸酶技术
锌指核糖核酸酶(ZFN) 由一个 DNA 识别域和一个非特异性核酸内切酶构成。DNA 识别域是由一系列 Cys2-His2锌指蛋白(zinc-fingers)串联组成(一般 3~4 个),每个锌指蛋白识别并结合一个特异的三联体碱基。锌指蛋白源自转录调控因子家族(transcription factor family),在真核生物中从酵母到人类广泛存在,形成alpha-beta-beta二级结构。其中alpha螺旋的16氨基酸残基决定锌指的DNA结合特异性,骨架结构保守。对决定DNA结合特异性的氨基酸引入序列的改变可以获得新的DNA结合特异性。现已公布的从自然界筛选的和人工突变的具有高特异性的锌指蛋白可以识别所有的GNN和ANN以及部分CNN和TNN三联体。多个锌指蛋白可以串联起来形成一个锌指蛋白组识别一段特异的碱基序列,具有很强的特异性和可塑性,很适合用于设计ZFNs。与锌指蛋白组相连的非特异性核酸内切酶来自FokI的C端的96个氨基酸残基组成的DNA剪切域(Kim et al., 1996)。FokI是来自海床黄杆菌的一种限制性内切酶,只在二聚体状态时才有酶切活性(Kim et al., 1994),每个FokI单体与一个锌指蛋白组相连构成一个ZFN,识别特定的位点,当两个识别位点相距恰当的距离时(6~8 bp),两个单体ZFN相互作用产生酶切功能。从而达到 DNA 定点剪切的目的。
2009年7月24日出版的《科学》杂志上,研究人员描述了创建带有永久性、可遗传基因突变大鼠的锌指核酸酶技术新应用,从而为开发出带有人类疾病的新型基因工程动物模型铺平了道路。锌指核酸酶技术将使此类动物的创建速度更快,也许还可能创造出不同于大鼠的其它实验物种。
威斯康辛医学院的人类和分子遗传学研究中心主任霍华德•雅各布医学博士说,到目前为止,大鼠遗传学家缺乏基因敲除或突变的可行技术,以了解这些特定基因的功能。此项研究表明,锌指核酸酶技术可绕过目前必需的繁琐实验环节,如核转移(克隆)或胚胎干细胞等,并允许快速地建立起新的动物模型。
这篇题为《经由胚胎微量注射锌指核酸酶创建基因敲除大鼠》的论文指出,科学家使用锌指核酸酶技术,在不影响对其他基因测量效果的情况下,敲除了一个插入的外来基因和两个天生的大鼠基因。重要的是,基因变异大鼠的后代也携带了这个变化,这表明这个基因改变是永久的和可遗传的。总之,研究结果展示出了将锌指核酸酶转运入早期胚胎,能快速建立起遗传并敲除整个生物体内的变异基因的能力。
2 RNA 水平
RNA干扰(RNA interference, RNAi)为第3代抑制哺乳动物细胞基因表达的有效方法. 他主要是指由外源或内源性的双链RNA(doubles t r a n d RNA, d sRNA)导入细胞而引起的与dsRNA同源的mRNA降解, 进而抑制相应的基因表达. dsRNA前体进入细胞后, 由核酸酶Ⅲ-Dicer处理为21-23个碱基的小干扰RNA(smallinterferencing RNA, siRNA). 这些小干扰RNA分子能与解螺旋酶、核酸酶等结合形成RNA诱导的沉默复合物(RNA inducing silencing complex,RISC), 并与靶基因的互补mRNA结合, 将mRNA降解, 在转录后水平抑制靶基因的表达, 因而又称为转录后基因沉默(post-transcriptional genesilencing, PTGS)[11-12]. RNA干扰出现的时间不长, 从1998年的初次报道开始[13], 短短几年中,RNAi的研究取得了突飞猛进的发展[14-15], 并被美国科学界评为2002年度最重要的科技成果之一. 2006年Andrew Fire和Craig Mello也正是凭借在RNA干扰领域所做出的杰出贡献而被授予诺贝尔医学奖[16]. 目前正在进行的基因组siRNA文库的建立必将为从全基因组水平对高等动物基因功能进行高通量RNAi研究打下坚实的基础[17]. 相对基因敲除, 反义寡核苷酸技术, RNA干扰技术在操作上相对简单, 基因沉默灭活效果可靠, 有望开发出新药应用于临床[18], 尤其是在肝炎和艾滋病等顽固性病毒性疾病的治疗中有可喜的应用前景[19-22]. 缺点是无法局限作用于特定组织和细胞, 这有赖于载体靶向系统研究的进展.
三、基因沉默的三种工具
现在常见有三种基因沉默的工具,siRNA、shRNA质粒和shRNA慢病毒颗粒,它们都可以有效敲降基因表达,那么这三种之间有什么区别呢?该选择哪一个呢?
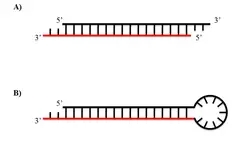
A、SiRNA的结构 B、ShRNA的结构
SiRNA是大约21个核苷酸(nt)构成的双链RNA,具有高度的序列特异性,细胞转染后可引发相应的mRNA快速降解,但持续时间较短。
短发夹RNA(shRNA) 通过载体(质粒或病毒)转染到细胞内,在细胞内转录生成shRNA,利用细胞内的Dicer酶,生成相应的siRNA,发挥RNAi作用。其中病毒感染细胞的效率较高,解决了质粒对于某些细胞类型(例如原代细胞和分裂较少的细胞)转染效率低的问题。
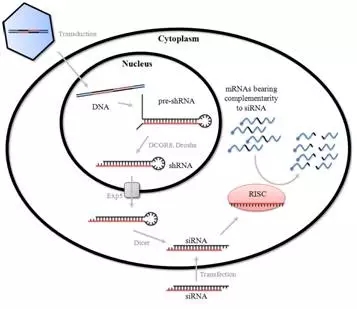
图:SiRNA介导的基因沉默机制
shRNA比siRNA的作用更稳定、持久,高效,并且能选择启动子控制shRNA的表达,能够与报告基因共表达,还能减少脱靶效应。但SiRNA操作更简便、起效迅速。
siRNA和shRNA之间进行选择时,要考虑的一个重要因素是实验时间的长短。siRNA在细胞中瞬时表达的,通常在3-5天内进行检测,而shRNA可以通过病毒或质粒介导的转染保持稳定。稳定转染的细胞常通过嘌呤霉素进行筛选,干扰的持续时间更久。而对于半衰期较长的基因表达产物来说,ShRNA是唯一选择。
为确保RNA干扰(RNAi)处理后观察到的效应是基因沉默的结果,而不是仅仅因为引入的siRNA/shRNA,别忘了设置相应的对照组。
